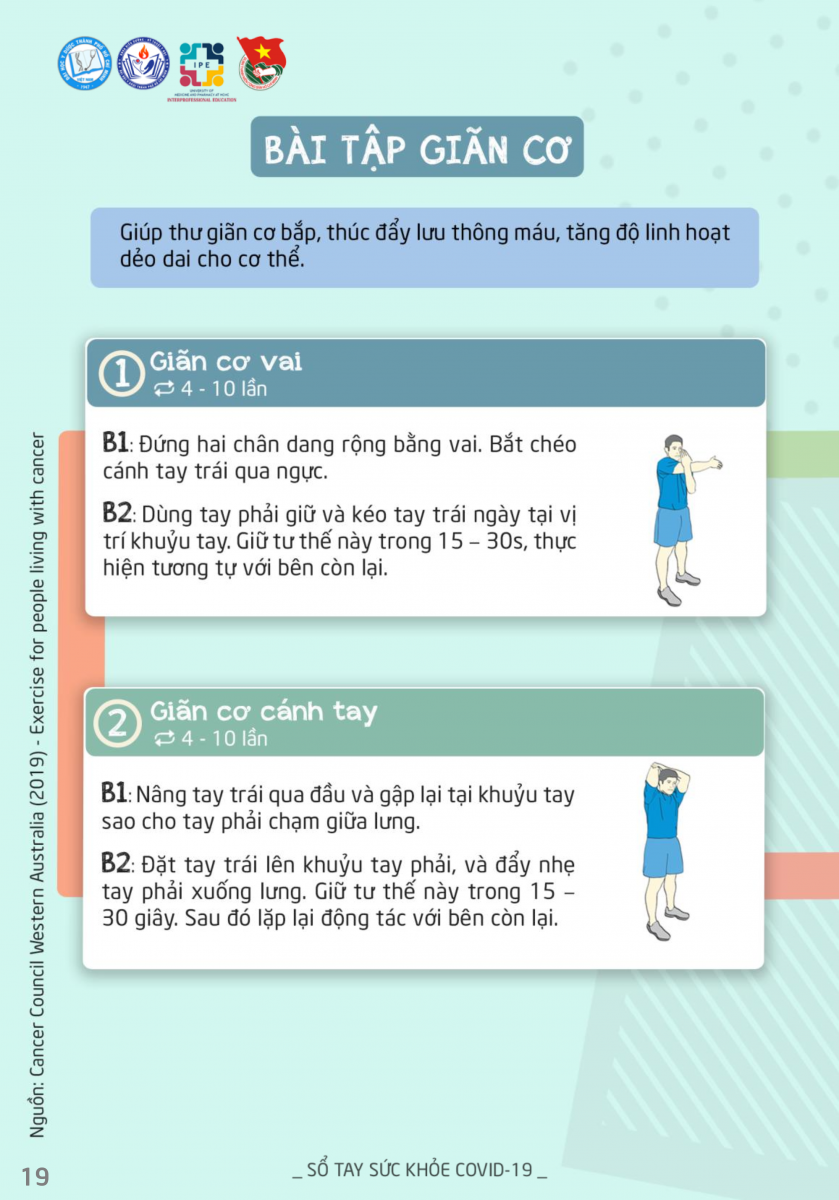
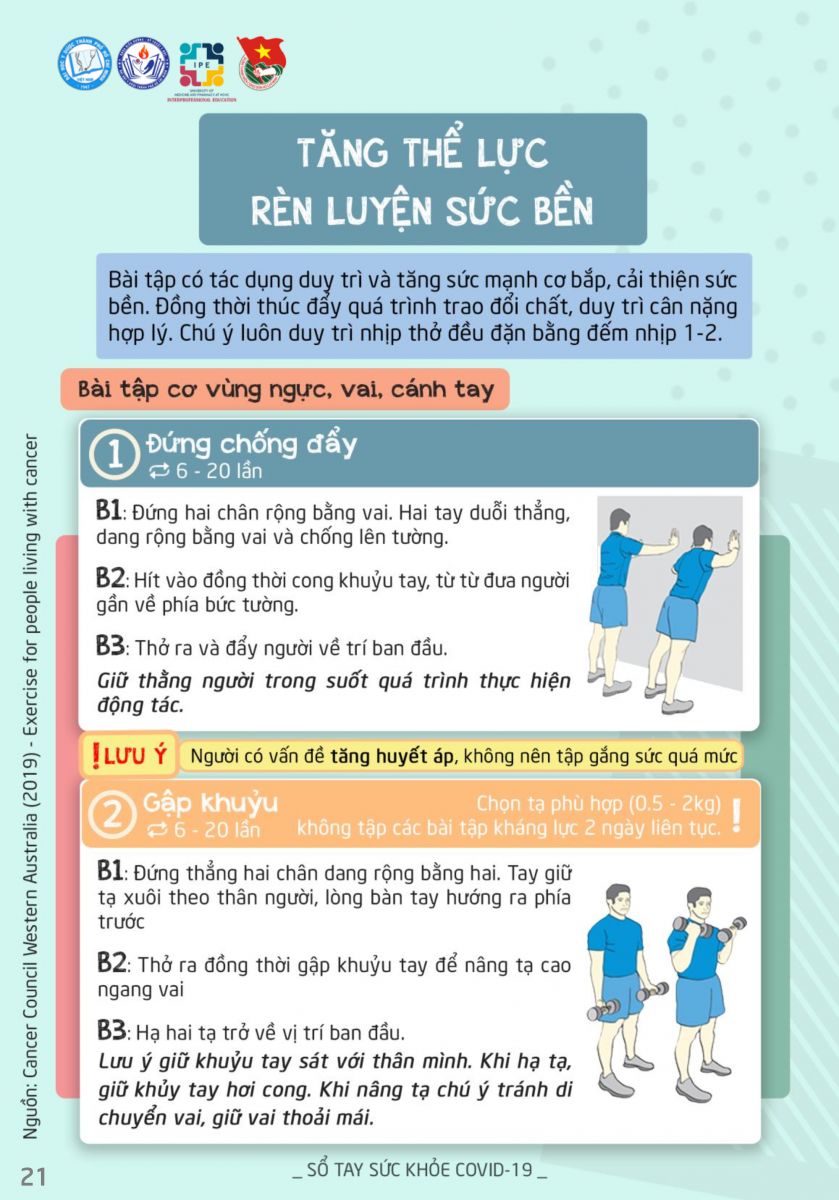
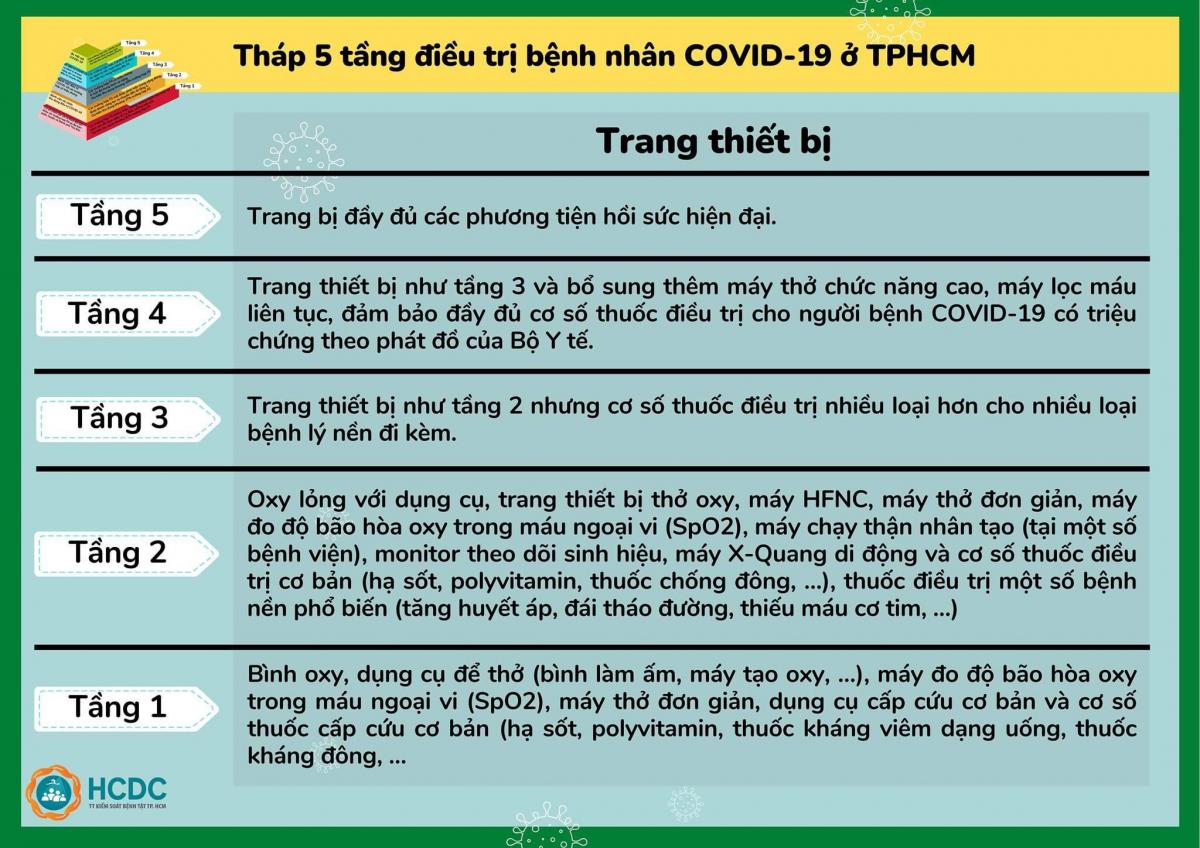
Vào ngày 1/5/2020, FDA (Mỹ) cho phép sử dụng Remdisivir trong điều trị những trường hợp nhiễm COVID-19 nặng (ca xác định hoặc nghi ngờ) ở người lớn và trẻ em, thuốc chỉ được sử dụng trong điều
trị nội trú.
Trước đó, Remdesivir đã được nghiên cứu trong các thử nghiệm lâm sàng đối với bệnh nhiễm vi-rút Ebola nhưng cho hiệu quả lâm sàng còn hạn chế, và tiếp tục được nghiên cứu trong các mô hình động vật đối với SARS-CoV và MERS-CoV.
Remdesivir là một loại thuốc kháng vi-rút phổ rộng do công ty dược phẩm sinh học Gilead Sciences phát triển. Đó là một loại thuốc tương tự adenosine nucleoside, được cho dùng theo đường tĩnh mạch dưới dạng một tiền chất (tiền thuốc), nhanh chóng xâm nhập vào các tế bào đích. Tại đó, thuốc được chuyển đổi thành một chất chuyển hóa nucleoside triphosphate có hoạt tính, được tích hợp vào chuỗi RNA của vi rút mới sinh trong tế bào chủ. Thuốc dẫn đến việc chấm dứt sớm quá trình tổng hợp RNA của vi rút bằng cách ức chế RNA polymerase phụ thuộc RNA. Liều dùng một lần mỗi ngày cho nồng độ thuốc có hoạt tính được duy trì liên tục trong tế bào. Không rõ dược động học của remdesivir trên bệnh nhân bị bệnh nặng, hoặc trên bệnh nhân bị suy thận hoặc suy gan và bất kỳ lần điều chỉnh liều lượng cần thiết nào. Thời gian sử dụng thuốc cho một đợt điều trị là 10 ngày.
Remdisivir được đánh giá dựa trên một phân tích dữ liệu từ một công trình nghiên cứu thử nghiệm ngẫu nhiên có kiểm soát với 1.063 bệnh nhân, bắt đầu vào ngày 21/2. Nghiên cứu này còn được gọi là Thử nghiệm điều trị COVID-19 thích nghi (Adaptive COVID-19 Treatment Trial - ACTT) được tài trợ bởi Viện Dị ứng và Bệnh truyền nhiễm Quốc gia (NIAID) – Mỹ. Đây là thử nghiệm lâm sàng đầu tiên tại Mỹ nhằm đánh giá một phương pháp điều trị thử nghiệm cho COVID -19. Người đầu tiên tham gia thử nghiệm này là một người Mỹ vừa được trở về nước sau khi bị cách ly trên tàu du lịch Diamond Princess cập cảng ở Yokohama, Nhật Bản và đã tình nguyện tham gia nghiên cứu tại địa điểm nghiên cứu đầu tiên - Trung tâm Y tế Đại học Nebraska / Nebraska Medicine vào tháng 2/2020. Tổng cộng có 68 địa điểm cuối cùng đã tham gia vào nghiên cứu của 47 tại Mỹ và 21 tại các quốc gia ở Châu Âu và Châu Á.
  |
Ban giám sát an toàn và dữ liệu độc lập (Data and Safety Monitoring Board - DSMB) đã họp vào ngày 27/4 để xem xét dữ liệu và chia sẻ phân tích tạm thời của họ với nhóm nghiên cứu. Dựa trên đánh giá dữ liệu, họ lưu ý rằng remdesivir tốt hơn giả dược về thời gian phục hồi, một dữ liệu đánh giá thường được sử dụng trong các thử nghiệm cúm. Tình trạng phục hồi trong nghiên cứu này được thiết kế phù hợp, khi đó bệnh nhân có thể xuất viện hoặc trở lại mức hoạt động bình thường. Kết quả sơ bộ của công trình nghiên cứu chỉ ra rằng những bệnh nhân sử dụng remdesivir có thời gian phục hồi nhanh hơn 31% so với những người dùng giả dược (p <0,001). Cụ thể, thời gian trung bình để phục hồi là 11 ngày đối với bệnh nhân được điều trị bằng Remdesivir so với 15 ngày đối với những người dùng giả dược. Kết quả cũng cho thấy tỷ lệ tử vong là 8,0% đối với nhóm nhận Remdesivir so với 11,6% đối với nhóm giả dược (p = 0,059).
Tóm lại, các nghiên cứu trên mô hình COVID-19 linh trưởng không phải trên người đã ghi nhận remdesivir có thể làm (1) giảm quá trình sao chép của vi rút ở phổi và (2) cải thiện tình trạng bệnh lý ở phổi, nếu được cho dùng sớm trong quá trình nhiễm bệnh.
Nguồn: Sở Y tế, MSD Manual